Что такое электролиз простым языком
Электролиз
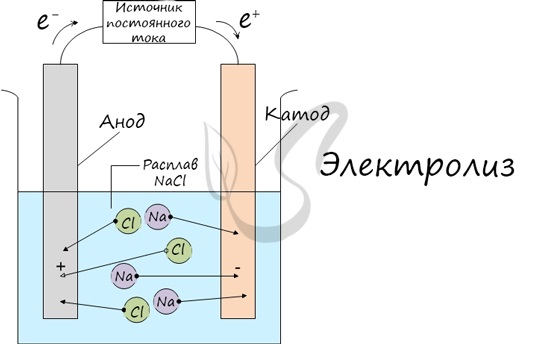
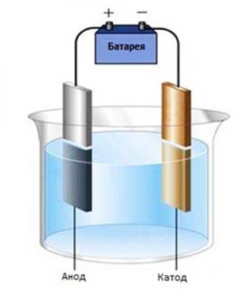
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
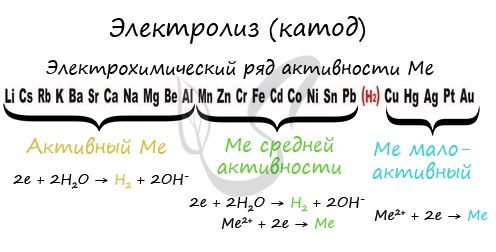
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Примеры решения
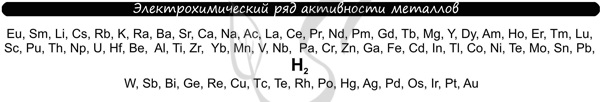
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
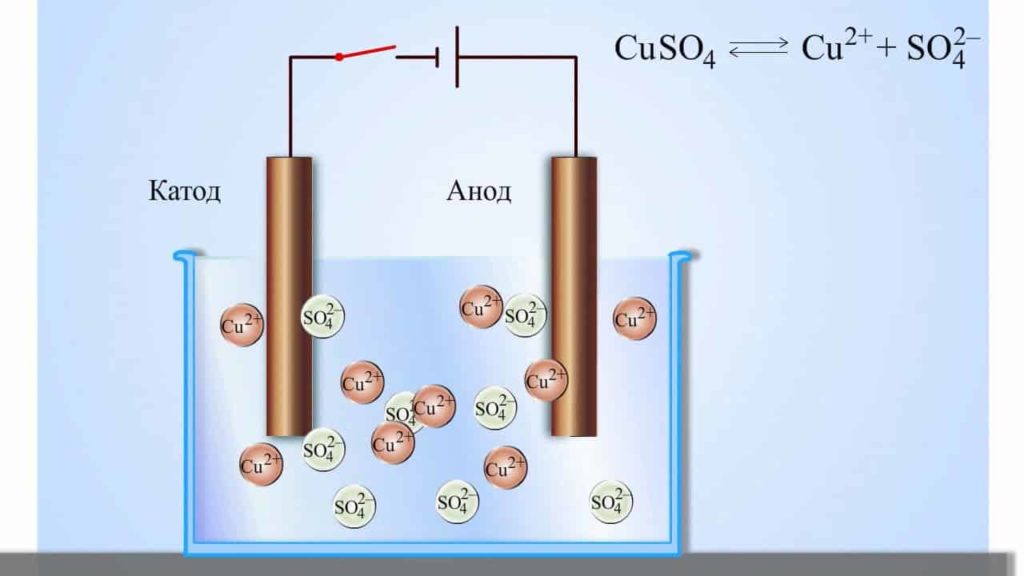
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
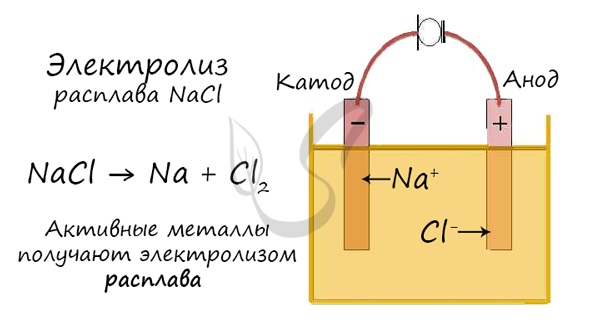
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Что такое электролиз и где он применяется на практике
Электролизом называется химический процесс при постоянном токе, заставляющий перемещаться ионы в требуемом направлении. Этот процесс нашел применение в многих отраслях промышленности – химической, металлургической и других. Любой раствор состоит из частиц, которые имеют положительный и отрицательный заряды.
Такое состояние является нестабильным, так как противоположные заряды притягиваются. Таким образом появляется частица с нейтральным зарядом или другими словами новая молекула другого вещества. В статье будет описан механизм электролиза, как он происходит, работает, в каких сферах он нашел применение.
В чём заключается процесс
Для организации процесса перемещения ионов в растворе нужно только два электрода и источник тока. Положительно заряженный электрод, называемый анодом, способствует окислению анионов, то есть отрицательно заряженных частиц, а также нейтральных молекул. Катод, то есть отрицательно заряженный электрод, притягивает к себе положительно заряженные ионы и нейтральные молекулы.
Особенности процессов, происходящих на катоде, заключаются в том, что здесь восстанавливаются обычно сильные окислители. Таким образом, с помощью двух пластинок с разницей потенциалов, помещённых в электролит, можно получать новые вещества, менять состояние электродов и раствора.
Для чего он нужен
Электролиз широко применяется для осуществления следующих процессов:
Этот список на самом деле гораздо обширней, поскольку с помощью разницы потенциалов можно с минимальными затратами добиваться значительного эффекта для разных целей.
Правила электролиза водных растворов
Электролиз на катоде зависит только от положения металла в электрохимическом ряду напряжений:
Промышленное применение электролиза
Электролиз широко используется в следующих сферах промышленности:
Если электроды погружать не в воду, а в растворы или расплавы солей, кислот и щелочей, то можно наблюдать выделение других газов и даже твёрдых веществ, оседающих на поверхности электродов. По этой причине электролиз широко применяют в технике. Рассмотрим самые важные направления его применения. Но перед этим запомним, что электрод, присоединяемый к «+» источника тока, называют анодом, а электрод, присоединяемый к «–» источника тока, называют катодом.
Электрометаллургия
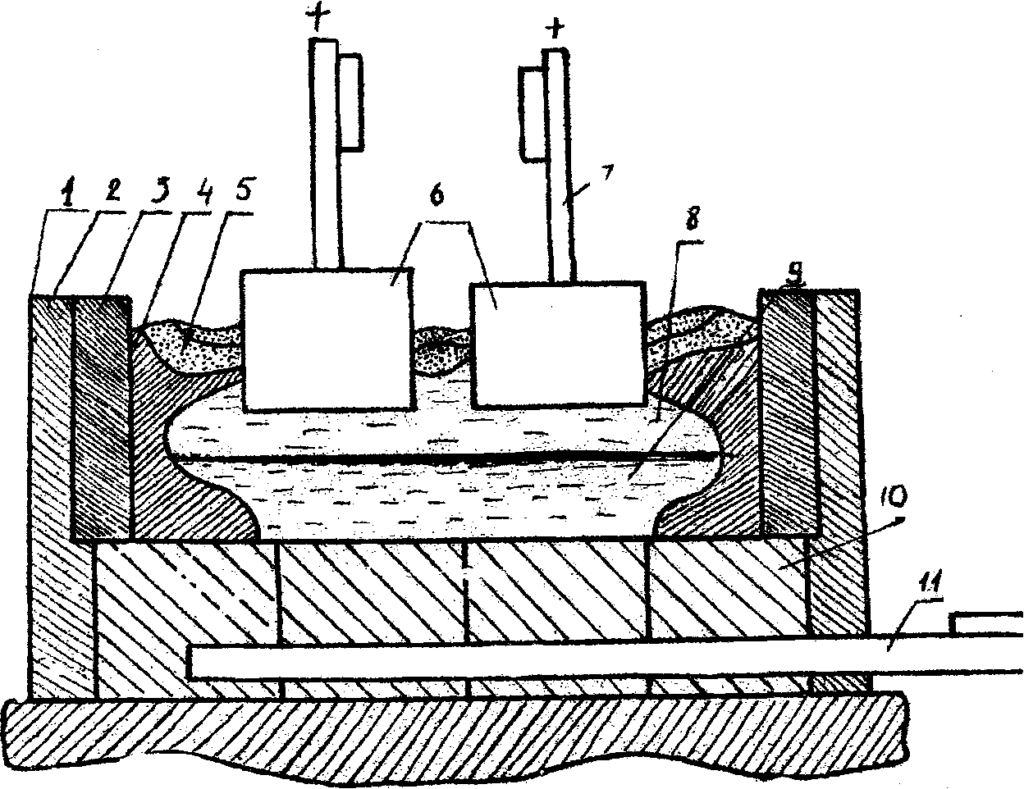
Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). В ванну опускают угольные стержни, которые служат анодами, а сама ванна – катодом. При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны.
Рафинирование (очистка) меди
Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название – медный купорос) и опускают две пластины: анод – толстую пластину из неочищенной меди и катод – тонкий лист из чистой меди.
Гальваностегия
Для придания изделиям красивого внешнего вида, прочности или для предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними.
Гальванопластика
Это электролитическое осаждение металла на поверхности какого-либо предмета для воспроизведения его формы. Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
Гальванополировка
Если резное металлическое изделие поместить в раствор электролита и включить ток, то наиболее сильное электрическое поле образуется у микроскопических выступов на поверхности этого изделия. Если оно подключено к «+» источника тока, то наиболее интенсивно ионы металла будут «вырываться» именно из выступов, и поверхность металла выровняется.
Электрофорез
От греч. «форезис» – перенесение), это лечебная процедура. Электроды накладывают на тело человека. Между телом и электродом помещают бумагу или ткань, пропитанную электропроводящим лекарственным препаратом. При включении тока начинается движение заряженных частиц из бумаги или ткани в кожу, а затем в тело человека. Так происходит процесс ввода лекарств, скорость которого можно регулировать, изменяя силу тока. Электролиз применяют также и для синтеза различных неорганических и органических веществ; это изучается в отдельной науке – электрохимии.
Процессы, протекающие при электролизе
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путем электролиза. Кроме того, электролиз используется для рафинирования (очистки) меди, никеля, свинца, а также для получения водорода, кислорода, хлора и ряда других химических веществ.
Сущность электролиза заключается в выделении из электролита при протекании через электролитическую ванну постоянного тока частиц вещества и осаждении их на погруженных в ванну электродах (электроэкстракция) или в переносе веществ с одного электрода через электролит на другой (электролитическое рафинирование). В обоих случаях цель процессов – получение возможно более чистых незагрязненных примесями веществ.
Электролиты являются проводниками второго рода. В этих растворах и расплавах имеет место электролитическая диссоциация – распад на положительно и отрицательно заряженные ионы. Если в сосуд с электролитом – электролизер поместить электроды, присоединенные к электрическому источнику энергии, то в нем начнет протекать ионный ток, причем положительно заряженные ионы – катионы будут двигаться к катоду (это в основном металлы и водород), а отрицательно заряженные ионы – анионы (хлор, кислород) – к аноду.
У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху. Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду (рис. 1). При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию).
Если же анод может растворяться в электролите по мере обеднения последнего, то частицы его, растворяясь в электролите, приобретают положительный заряд и направляются к катоду, на котором осаждаются, тем самым осуществляется перенос материала с анода на катод. Так как при этом процесс ведут так, чтобы содержащиеся в металле анода примеси не переносились на катод, такой процесс называется электролитическим рафинированием.
Если электрод поместить в раствор с ионами того же вещества, из которого он изготовлен, то при некотором потенциале между электродом и раствором не происходит ни растворения электрода, ни осаждения на нем вещества из раствора. Такой потенциал называется нормальным потенциалом вещества. Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс).
Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. Если в электролите имеются ионы разных металлов, то первыми на катоде выделяются ионы, имеющие меньший отрицательный нормальный потенциал (медь, серебро, свинец, никель), щелочноземельные металлы выделить труднее всего. Кроме того, в водных растворах всегда имеются ионы водорода, которые будут выделяться ранее, чем все металлы, имеющие отрицательный нормальный потенциал, поэтому при электролизе последних значительная или даже большая часть энергии затрачивается на выделение водорода.
Путем специальных мер можно воспрепятствовать в известных пределах выделению водорода, однако металлы с нормальным потенциалом меньше 1 В (например, магний, алюминий, щелочноземельные металлы) получить электролизом из водного раствора не удается. Их получают разложением расплавленных солей этих металлов. Нормальные электродные потенциалы веществ, указанные в табл. 1, являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
С другой стороны, увеличивая перенапряжение для ионов водорода, можно затруднить его выделение на катоде, что позволяет получить электролизом из водных растворов ряд таких более отрицательных по сравнению с водородом металлов, как свинец, олово, никель, кобальт, хром и даже цинк. Это достигается ведением процесса при повышенных плотностях тока на электродах, а также введением в электролит некоторых веществ.
Течение катодных и анодных реакций при электролизе определяется следующими двумя законами Фарадея.
Масса вещества mэ, выделившегося при электролизе на катоде или перешедшего с анода в электролит, пропорциональна количеству прошедшего через электролит электричества Iτ: mэ = α/τ,здесь а – электрохимический эквивалент вещества, г/Кл.
Теоретическая часть
Электролиз – совокупность окислительно-восстановительных реакций, протекающих под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне. Электролиз проводят в особых приборах – электролизерах. Это сосуд с раствором или расплавом электролита и опущенными в него электродами из металла или графита. К электродам прикладывают разность потенциалов от внешнего источника постоянного тока. Катод отдает электроны частицам вещества в электролите и восстанавливает их. Анод отбирает электроны от частиц в электролите, окисляя их.
При электролизе процессы окисления и восстановления протекают на различных электродах – аноде и катоде. Анод – это электрод, на котором происходит процесс окисления. При электролизе анод заряжен положительно. Катод – это электрод, на котором происходит процесс восстановления. При электролизе катод заряжен отрицательно. На окислительно-восстановительные процессы, протекающие при электролизе, влияют различные факторы:
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл: Men+ +nē = Me0 На аноде будет окисляться кислород в составе гидроксид-группы: 4OH− −4ē =2H2O + O2 Электролиз расплавов солей 1. Электролиз расплава бескислородной соли: На катоде всегда восстанавливается металл: Men + nē = Me0 На аноде окисляется бескислородный анион: A n– – nē = A0 Например: Электролиз расплава NaCl: 2NaCl = 2Na + Cl2 2.Электролиз расплава кислородсодержащей соли (элемент аниона находится не в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде будет окисляться элемент аниона: SO3 2– – 2ē = SO3 0 Например, электролиз расплава сульфита натрия: Na2SO3 = 2Na + SO3 Сера S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 (SO3). 3.
Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде: т.к. элемент уже в высшей степени окисления, то окисляться будет кислород, например: 2CO3 –2 – 4ē = 2CO2 + O2 Например, электролиз расплава карбоната натрия: 2Na2CO3 = 4Na + 2CO2+ O2 Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока. Электролиз растворов На катоде могут протекать следующие реакции восстановления.
Что такое электролиз и где он применяется?
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.
Что такое электролиз?
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.
Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:
k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F), где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.
При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.
Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.
Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.
Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.
Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.